Le proteine sono polimeri di molecole contenenti azoto chiamate Aminoacidi, ordinate in una sequenza lineare. I sistemi viventi utilizzano però soltanto 20 diversi aminoacidi per formare le proteine. Le molecole proteiche ne contengono alcune centinaia, se non di più, quindi il numero di sequenze aminoacidiche possibili e di conseguenza la gamma di molecole proteiche realizzabili è veramente ampia.
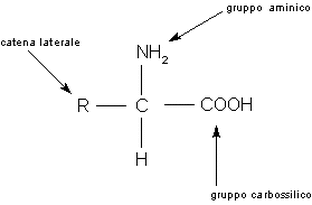
Sappiamo che ogni specifica proteina ha una disposizione precisa degli aminoacidi, i quali hanno tutti la stessa struttura di base, costituita da un gruppo amminico -NH2, un gruppo carbossilico -COOH, e un atomo di idrogeno, legati allo stesso atomo di carbonio centrale. Le differenze tra i vari amminoacidi però sono date da un gruppo, il gruppo R, che può essere costituito da uno o più atomi.
E' noto che tra i 20 aminoacidi che vengono utilizzati per costruire le proteine, 9 sono definiti ESSENZIALI, poiché non possono essere sintetizzati dall'organismo, ma devono essere introdotti tramite l'alimentazione. Gli aminoacidi essenziali sono: lisina, triptofano, treonina, metionina, istidina, fenilalanina, leucina, valina e isoleucina.
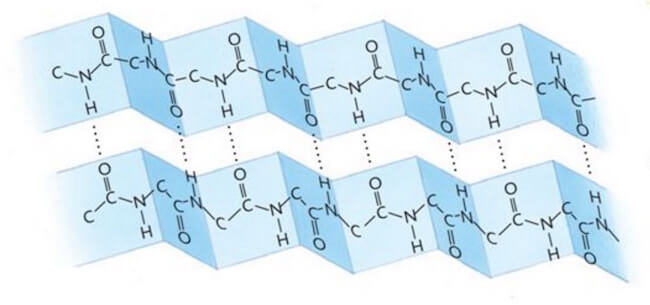
Sappiamo comunque che il gruppo amminico di un aminoacido si lega al gruppo carbossilico dell'aminoacido adiacente. Questo legame covalente tra due aminoacidi è detto Legame Peptidico e l'unione di molti aminoacidi forma il Polipeptide. Le proteine non sono altro che grandi polipeptidi, e talvolta sono costituite da più polipeptidi. Queste grandi molecole hanno un peso molecolare notevole, varia infatti tra 10^4 (10.000) e 10^6 (1.000.000).
La struttura delle proteine è comunque organizzata in livelli, abbiamo infatti:
STRUTTURA PRIMARIA: costituita dalla sequenza lineare di aminoacidi di quella specifica proteina. Sappiamo che la sequenza di aminoacidi determina la struttura della molecola del polipeptide e di conseguenza la struttura e la funzione biologica della proteina. Per questo anche una minima variazione della sequenza aminoacidica può portare alla perdita di funzionalità della proteina.
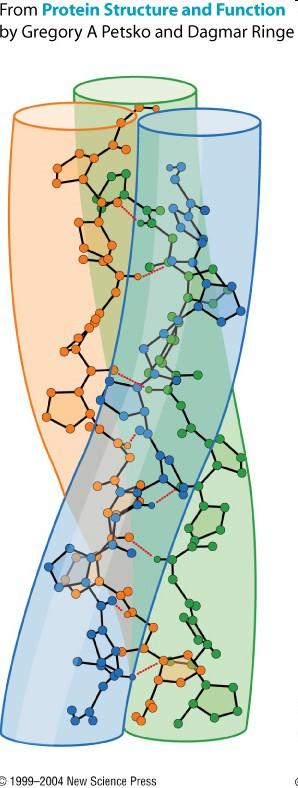
| Ⲁ-elica |
Sappiamo che una proteina può: o presentare una sola tipologia di struttura secondaria, quindi o Ⲁ-elica o foglietto 𝛃, oppure può presentare entrambe le tipologie. Detto ciò, distinguiamo proteine Fibrose e proteine Globulari.
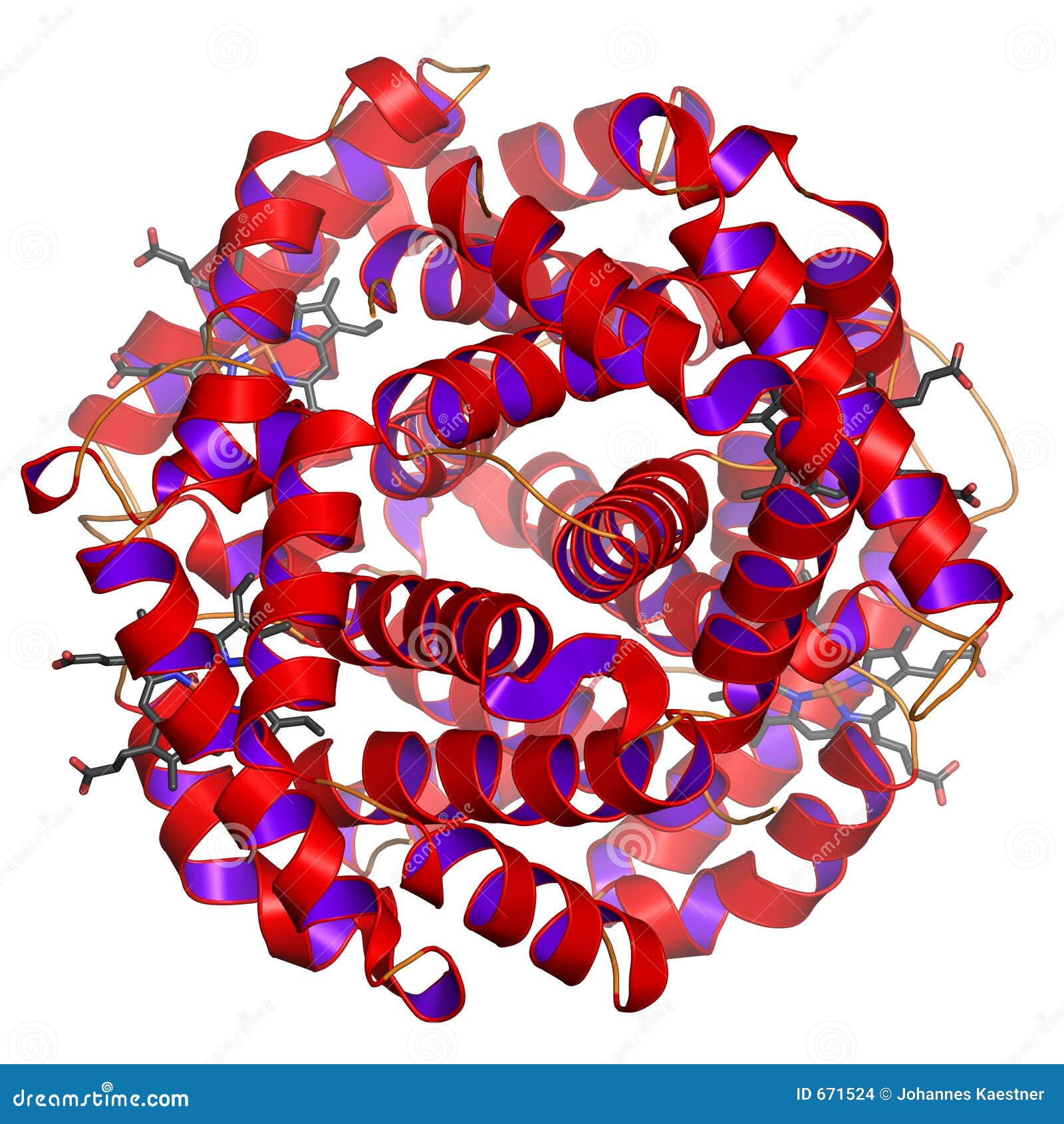
secondaria. In queste proteine inoltre, la struttura secondaria si ripiega a formare una STRUTTURA TERZIARIA; il ripiegamento, in alcune proteine, avviene spontaneamente in un processo di autoassemblaggio, ma in altre abbiamo l'intervento di particolari proteine, dette Chaperoni Molecolari, che facilitano questo processo inibendo la formazione di ripiegamenti non corretti. Sappiamo comunque che la maggior pare delle proteine biologicamente attive sono globulari: enzimi, proteine di membrana, proteine di trasporto, gli stessi microtubuli che troviamo nelle cellule, sono costituiti da tante unità sferiche, ognuna delle quali una proteina globulare.
STRUTTURA QUATERNARIA: le proteine possono essere costituite da più catene polipeptidiche, le quali sono unite tra loro da legami idrogeno, ponti disolfuro, forze idrofobe, attrazione tra cariche opposte, o da una combinazione di questi legami. L'interazione tra le catene polipeptidiche costituisce quindi la struttura quaternaria della proteina.
Particolare attenzione meritano gli Enzimi: proteine globulari che svolgono un ruolo fondamentale nei sistemi biologici. Gli enzimi infatti fungono da catalizzatori. I catalizzatori sono sostanze capaci di aumentare la velocità di una reazione chimica, rimanendo comunque inalterate durante il processo. Proprio per questo possono essere riutilizzati e quindi sono sufficienti in piccole quantità. Inoltre il nome di un enzima è generalmente forma aggiungendo il suffisso -asi al nome del suo substrato, per esempio: Amilasi, catalizza l'idrolisi dell'amilosio, Saccarasi, catalizza l'idrolisi del saccarosio e così via.




Commenti
Posta un commento